
题目列表(包括答案和解析)
(12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产
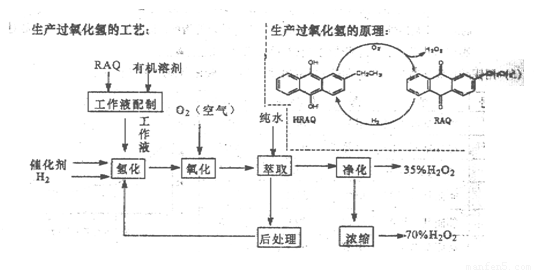
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为 。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是 。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是 。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是 。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为 。
(12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为 。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是 。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是 。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是 。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为 。
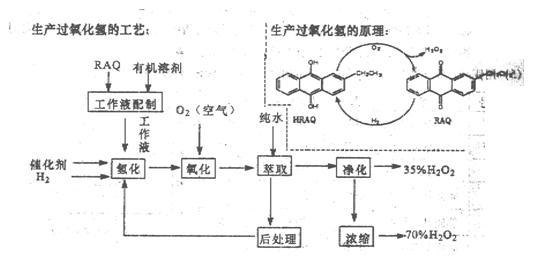
(12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产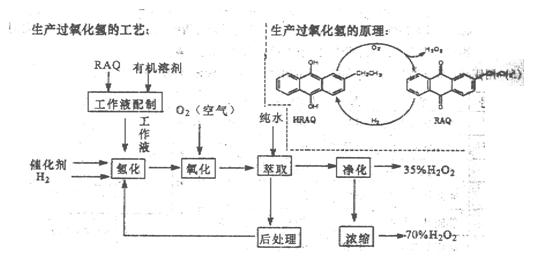
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为 。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是 。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是 。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是 。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为 。
过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为 。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是 。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是 。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是 。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为 。
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| D | D→Cu | +1.35 |
| E | E→Cu | +0.30 |
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com