
题目列表(包括答案和解析)
A.(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.(12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ,用方程式表示碘瓶必须干燥的原因 。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有 。
A.(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:

②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。

B.(12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ,用方程式表示碘瓶必须干燥的原因 。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有 。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
![]()
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。

B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①![]() ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ,用方程式表示碘瓶必须干燥的原因 。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有 。
已知:I2+2S2O32—=S4O62—+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量分数为________。
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
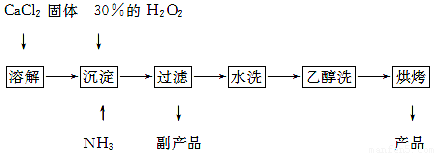
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是????????????????????????????? ;
(2)检验“水洗”是否合格的方法是???????????????????????????????????????? ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①????????????????????????????????????????????????????????????????? ;
②?????????????????????????????????????????????????????????????????? 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为??????????? (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能??????? (填“不受影响”、“偏低”或“偏高”),原因是????????????????????????????????????????????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com