
题目列表(包括答案和解析)
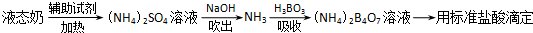
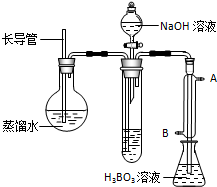
| 编号 | 样品和辅助试剂 | 消耗盐酸体积 |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45mL |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55mL |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50mL |
| 4 | 10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 | 1.50mL |
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) ![]() Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
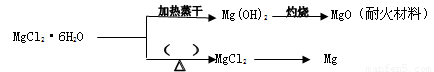
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________
有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________
有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用: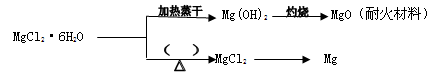
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
![]()
![]()
![]()
![]()
![]() Mg(OH)2 MgO(耐火材料)
Mg(OH)2 MgO(耐火材料)
![]()
![]() MgCl2·6H2O
MgCl2·6H2O
![]()
![]()
![]() MgCl2 Mg
MgCl2 Mg
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) ![]() Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com