
题目列表(包括答案和解析)
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适合电器及其他仪器使用,必须进行电解精炼。表1为几种物质的溶度积。
表1:几种物质的溶度积
物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
溶度积Ksp | 8.0×10-16 | 4.0×10-38 | 3×10-17 | 2.2×10-20 |
(1)在精炼铜时,阳极是 (填“纯铜板”或“粗铜板”);金、银失电子能力比铜弱,因此以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底,阴极电极反应方程式是 。
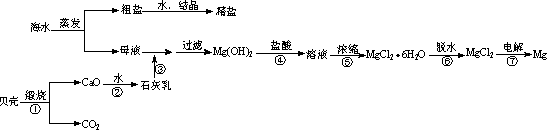
(2)在精炼铜的过程中,Cu2+浓度逐渐减少,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了除杂方案(见下图)。
①试剂a是 ,加入试剂a的目的是 。
②操作①是 ,根据溶度积,除杂方案中能够除去的杂质金属阳离子是 。
③乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节PH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的除杂方案中也应该将溶液PH调至7~8。你认为乙同学的建议是否正确?(填“是”或“否”) ,
理由是 。
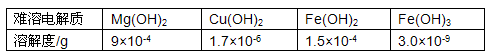
海洋是资源的宝库,海水中所含食盐高达4×1016t。用海水可生产食盐和金属
镁或镁的化合物,其过程如下图所示。
 (1)贝壳主要成分的化学式 。
(1)贝壳主要成分的化学式 。
(2)步骤④反应的离子方程式 。
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤。
A.粗盐提纯过程中过滤的目的是 (填序号)
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒 、 。
(4)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物。某些材料因含有Mg(OH)2而具有阻燃性。简析Mg(OH)2能够阻燃的原因。
① ②
(5)电解MgCl2制金属Mg的反应方程式为:MgCl2![]() Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg g,同时可得到氯气 L(标准状况)。
Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg g,同时可得到氯气 L(标准状况)。
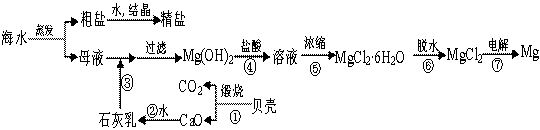
| 难容电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com