
题目列表(包括答案和解析)

图6-4
(1)造成X河污染的主要污染源最可能分布在( )
A.ab段 B.bc段 C.cd段 D.bd段
(2)列举造成X河污染的三种可能的污染源。
(3)对c处水样进行检测,发现其中含有Cu2+等重金属离子。若要把铜离子变为单质铜回收,请完成两种回收的方法:
方法Ⅰ:_______________________________________________________________。
方法Ⅱ:______________________________________________________________。
(4)d处的污染程度比a处明显降低,请从物理学、化学、生物学三个方面简单分析其原因。
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |


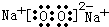
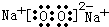


(16分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式为___ __,D的原子结构示意图为___ __。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有_____ _(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com