
题目列表(包括答案和解析)
|
取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 | |
| [ ] | |
A. |
0.21 mol·L-1 |
B. |
0.42 mol·L-1 |
C. |
0.56 mol·L-1 |
D. |
0.26 mol·L-1 |
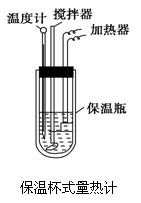
在量热计中(如图)将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。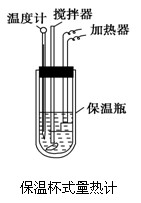
(1).试求CH3COOH的中和热ΔH表达数值式。
(2).上述数值结果与57.3 kJ/mol有偏差,产生原因可能是
a.实验装置保温、隔热效果差
b.配制0.55 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
钠及其化合物具有广泛的用途.
(1)工业上可利用反应Na(1)+KCl(1)![]() K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如下:

负极电极反应式为________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为________.
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是________,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号).
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300 mL 1 mol·L-1的NaOH溶液吸收标准状况下4.48 LCO2时,所得溶液中各离子浓度由大到小的顺序为________.
几种离子开始沉淀时的pH如下表:
![]()
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[(Fe(OH)2)]________Ksp[(Mg(OH))2](填“>”、“=”或“<”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com