
题目列表(包括答案和解析)
食盐是日常生活的必需品,也是重要的化工原料。
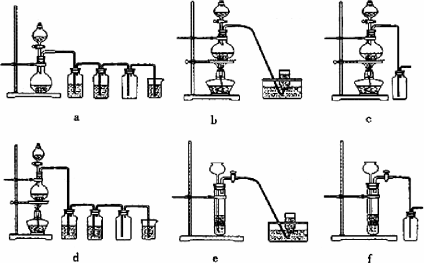
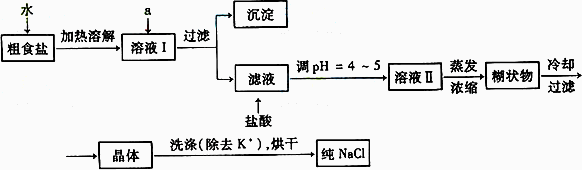
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
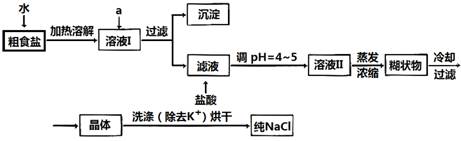
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_______ __(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____ ____。
 (2)用提纯的NaCl配制500 mL4.00
mol·L-1NaCl溶液,
(2)用提纯的NaCl配制500 mL4.00
mol·L-1NaCl溶液,
所用仪器除天平、药匙、玻璃棒外还有___ _____
(填仪器名称)。
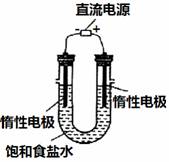
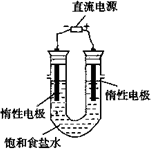
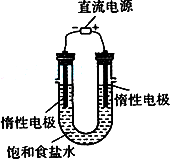
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2_____(填“>”、“=”或“<”)2 L,
原因是_________。装置改进后,可用于制备NaOH溶液,
若测定溶液中NaOH的浓度,常用的方法是__________。
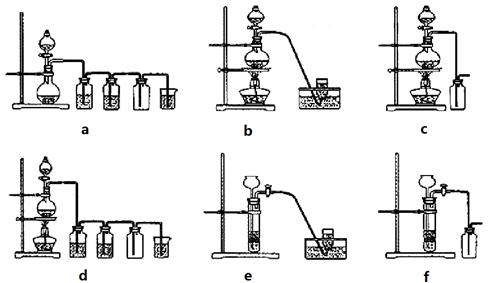
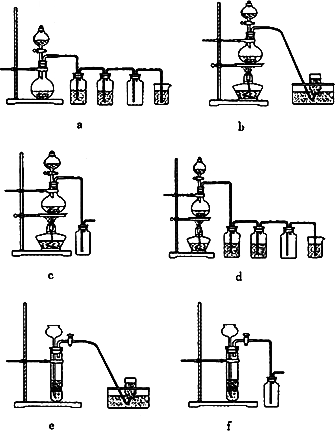
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4
ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
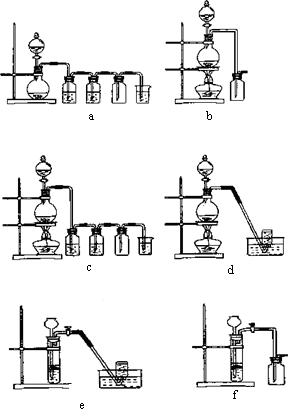
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
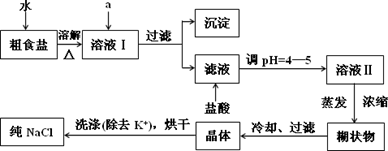
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液,75%乙醇,四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1的NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________.
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
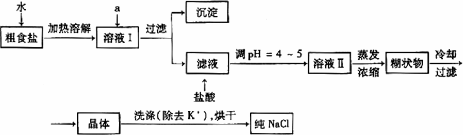
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是________.
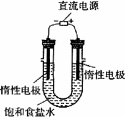
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________(填选项)
A.蒸馏水
B.75%的乙醇溶液
C.无水乙醇
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________.
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
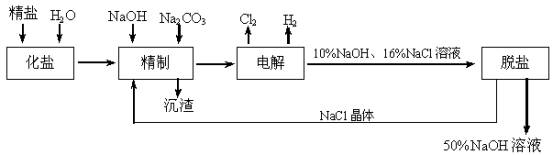
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的离子方程式为
。
与电源负极相连的电极附近,溶液pH (选填:不变,升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
。
(3)如果粗盐中SO42-含量较高;必须添加钡试剂除去SO42-,该钡试剂可以是
(选填a,b,c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-;加入试剂的合理顺序是 (选填a,b,c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、
(填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com