
题目列表(包括答案和解析)
| 实验事实 | 结论或解释 | ① | 将40g NaOH溶于1L蒸馏水中 | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1molL-1 | ② | 向盛有1mL 0.1mol?L-1AgNO3溶液的试管中滴加0.1molL-1NaCl溶液,至不再有沉淀生成,再向其中滴0.1molL-1 KI溶液,白色沉淀转化为黄色沉淀. |
常温下 Ksp(AgCl)<Ksp(AgI) |
③ | 某盐NaX溶液pH>7 | 酸HX为弱酸 | ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 说明溶液中一定含有Fe2+ | ⑤ | 向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al<Cu | ⑥ | BaSO4的水溶液导电性很差 | BaSO4是弱电解质 |
| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |



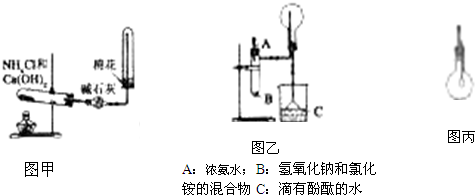
 NH3?H2O
NH3?H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 NH3?H2O
NH3?H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小(2011?东城区模拟)从下列事实所得出的结论或给出的解释正确的是( )
|
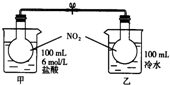 如右图所示,两烧瓶中充入NO2气体,存在如下平衡:2NO2(g)?N2O4(g)△H<0;烧杯甲中盛放100mL 6mol?L-1的HCl溶液,烧杯乙中盛放100mL冷水,现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如右图所示,两烧瓶中充入NO2气体,存在如下平衡:2NO2(g)?N2O4(g)△H<0;烧杯甲中盛放100mL 6mol?L-1的HCl溶液,烧杯乙中盛放100mL冷水,现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com