
题目列表(包括答案和解析)
 的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮.当两个烃基都是脂肪烃(链烃)基时,叫做脂肪酮,例如丙酮
的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮.当两个烃基都是脂肪烃(链烃)基时,叫做脂肪酮,例如丙酮  ;含有芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫脂环酮,例如环已酮
;含有芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫脂环酮,例如环已酮  .
. C、HCHO
C、HCHO
 是属于
是属于 ,它不仅是一种家用杀虫剂,而且还是香料、塑料、医药工业的重要原料,它的分子式为
,它不仅是一种家用杀虫剂,而且还是香料、塑料、医药工业的重要原料,它的分子式为 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
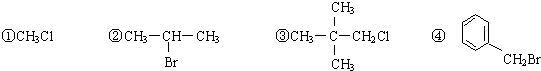
| A、①② | B、②③④ | C、①②③④ | D、② |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com