
题目列表(包括答案和解析)
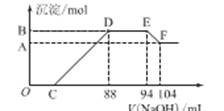
(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
OC段 ,
DE段 ,
EF段___________________________________ __________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①O→C:H++OH-===H2O;②C→88:R3++3OH-===R(OH)3↓(R代表Fe或Al);③88→94:NH+OH-===NH3·H2O;④94→104:Al(OH)3+OH-===AlO+2H2O。由④知n[Al(OH)3]=0.01 L×4 mol·L-1=0.04 mol=n(Al)。由③知,n(NH4NO3)=0.006 L×4 mol·L-1=0.024 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.024×8=0.192 mol,则n(R3+)=0.064 mol=n(合金),故混合物中n(Fe)=0.024mol。0→88 mL中,用于沉淀金属离子的OH-有0.064 mol×3=0.192 mol,故C点:(0.088 L×4 mol·L-1-0.192 mol)÷4 mol·L-1=0.04 L,即40 mL。据原子守恒可知硝酸的物质的量是0.094L×4mol/L=0.376mol。其浓度是3.76mol/L。
(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
OC段 ,
DE段 ,
EF段___________________________________ __________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①O→C:H++OH-===H2O;②C→88:R3++3OH-===R(OH)3↓(R代表Fe或Al);③88→94:NH+OH-===NH3·H2O;④94→104:Al(OH)3+OH-===AlO+2H2O。由④知n[Al(OH)3]=0.01 L×4 mol·L-1=0.04 mol=n(Al)。由③知,n(NH4NO3)=0.006 L×4 mol·L-1=0.024 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.024×8=0.192 mol,则n(R3+)=0.064 mol=n(合金),故混合物中n(Fe)=0.024mol。0→88 mL中,用于沉淀金属离子的OH-有0.064 mol×3=0.192 mol,故C点:(0.088 L×4 mol·L-1-0.192 mol)÷4 mol·L-1=0.04 L,即40 mL。据原子守恒可知硝酸的物质的量是0.094L×4mol/L=0.376mol。其浓度是3.76mol/L。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com