
题目列表(包括答案和解析)
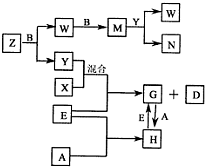 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):

 5N2+6H2O
5N2+6H2O 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+①3∶1 ②3∶2 ③3∶4 ④3∶5
A.①② B.①③ C.②③ D.③④
(2)硝酸工业的尾气中主要含有NO、NO2气体,工业上可用氨气进行治理,使其转化为无毒的氮气。有关反应的化学方程式为:
6NO+4NH3![]() 5N2+6H2O
5N2+6H2O
6NO2+8NH3![]() 7N2+12H2O
7N2+12H2O
现有NO和NO2的混合气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com