
题目列表(包括答案和解析)
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出X的电子式:??????????? 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为?????????? (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式:????????????? 。
(4)写出反应③的离子方程式:??????????????????? 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别???????????????? (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明????????????????????????????? 。
| 14000C(V3-V2) |
| a |
| 14000C(V3-V2) |
| a |
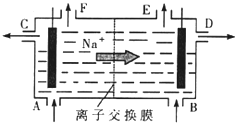 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”. A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).

| ||
| ||
 Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体 Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体


| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com