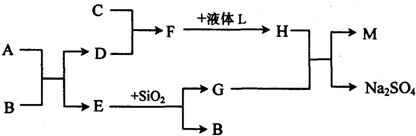
[化学一化学与技术]铝是地壳中含量最多的金属元素,1854年法国化学家德维尔用金属钠还原氯化钠和氯化铝的复盐,获得了金属铝单质.1886年,美国人豪尔和法国人海郎特,分别独立地电解熔融的氧化铝和冰晶石的混合物,制得了金属铝,奠定了今天大规模生产铝的基础.工业生产金属铝的原料是铝土矿(主要成分为Al
2O
3,另含有Fe
2O
3和SiO
2),工业中得到较纯氧化铝的过程如图所示:
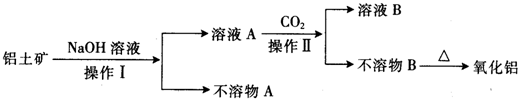
试回答下列问题:
(1)操作I是一种重要的混合物分离方法,实验室进行该项操作用到的玻璃仪器有烧杯、
、
.
(2)经分析不溶物A的主要成分为
.
(3)工业上电解炼铝的化学方程式为
,若电路中通过1mol电子,可以得到铝
g.
(4)操作Ⅱ中生成不溶物B的离子方程式是
.
(5)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用.其部分转化关系如图所示:
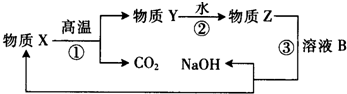
①上述转化中未涉及四种基本反应类型中的
反应;
②写出③的化学方程式(该反应在工业生产中称为苛化法)
.
(6)科学研究表明,人体过量摄入铝元素会严重危害身体健康.请你结合实际提出两条杜绝铝元素过量摄入的措施:
.