
题目列表(包括答案和解析)
实验是进行化学研究的重要手段之一.请回答下列问题:
(1)下列实验操作,错误的是________(填写序号).
a.用纸槽往试管里装粉末状药品时,试管应先横放再直立
b.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450 mL 0.1 mol·L-1 NaOH溶液和500 mL 0.5 mol·L-1硫酸溶液.请回答下
列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有________.

②在容量瓶的使用方法中,下列操作正确的是________(填写序号).
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水.
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
③配制450 mL 0.1 mol·L-1 NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为________g.
b.称量氢氧化钠固体.
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
上述步骤的正确操作顺序为________(用序号表示).
④根据计算得知,需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL,如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好.
(8分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: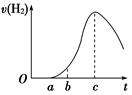
(1)曲线由O →a段不产生氢气的原因是____________________________________________________________;
有关反应的化学方程式为
__________________________________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________________
________________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
(8分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:

(1)曲线由O →a段不产生氢气的原因是____________________________________________________________;
有关反应的化学方程式为
__________________________________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________________
________________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
.将5 mol·L-1盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是
A.0.05 mol·L-1 B.0.25 mol·L-1
C.0.1 mol·L-1 D.0.5 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com