
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| ||
| ||
(16分)1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O NH4HCO3; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
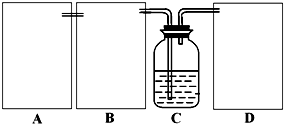
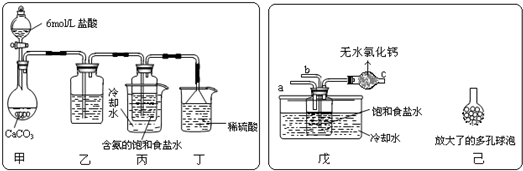
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示
(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com