
题目列表(包括答案和解析)
(13分)Ⅰ下列实验操作、现象、结论、说法不正确的是_______________(填序号)
①.苯酚沾在手上立即用酒精洗涤
②.除去淀粉中的少量氯化钠,可以加蒸馏水,用渗析的方法
③.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
④.制取乙酸乙酯用如右图所示的实验装置
⑤.区别植物油和直馏汽油的正确方法是将它们分别滴入溴水当中,稍加振荡,
观察溴水的颜色是否褪去
⑥.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3溶液以检验其是否发生水解
⑦.皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析
⑧.在蔗糖溶液中滴加几滴稀硫酸,微热,加入新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ 实验室需要0.5 mol/L硫酸溶液480mL。回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。
(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。
(3)配制时,该同学的操作顺序如下,请将操作步骤C补充完整。
A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却
B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中①
C._______________________________________________________________________
D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处
E.改用胶头滴管滴加,直至凹液面刚好与刻度线相切
F.将容量瓶盖紧,振荡,摇匀
(4)若实验遇到下列情况,会导致硫酸溶液的物质的量浓度偏低的是__________(填序号)
①用以稀释硫酸的烧杯未洗涤
②量取浓硫酸的量筒未洗涤
③摇匀后发现液面低于刻度线再加水
④容量瓶中原有少量蒸馏水
⑤定容时观察液面俯视
(13分)Ⅰ下列实验操作、现象、结论、说法不正确的是_______________(填序号)
①.苯酚沾在手上立即用酒精洗涤
②.除去淀粉中的少量氯化钠,可以加蒸馏水,用渗析的方法
③.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
④.制取乙酸乙酯用如右图所示的实验装置
⑤.区别植物油和直馏汽油的正确方法是将它们分别滴入溴水当中,稍加振荡,
观察溴水的颜色是否褪去
⑥.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3溶液以检验其是否发生水解
⑦.皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析
⑧.在蔗糖溶液中滴加几滴稀硫酸,微热,加入新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ 实验室需要0.5 mol/L硫酸溶液480mL。回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。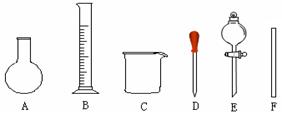
(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。
(3)配制时,该同学的操作顺序如下,请将操作步骤C补充完整。
| A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却 |
| B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中① |
| C._______________________________________________________________________ |
| D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处 |
(13分)Ⅰ下列实验操作、现象、结论、说法不正确的是_______________(填序号)

①.苯酚沾在手上立即用酒精洗涤
②.除去淀粉中的少量氯化钠,可以加蒸馏水,用渗析的方法
③.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
④.制取乙酸乙酯用如右图所示的实验装置
⑤.区别植物油和直馏汽油的正确方法是将它们分别滴入溴水当中,稍加振荡,
观察溴水的颜色是否褪去
⑥.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3溶液以检验其是否发生水解
⑦.皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析
⑧.在蔗糖溶液中滴加几滴稀硫酸,微热,加入新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ 实验室需要0.5 mol/L硫酸溶液480mL。回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。

(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。
(3)配制时,该同学的操作顺序如下,请将操作步骤C补充完整。
A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却
B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中①
C._______________________________________________________________________
D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处
E.改用胶头滴管滴加,直至凹液面刚好与刻度线相切
F.将容量瓶盖紧,振荡,摇匀
(4)若实验遇到下列情况,会导致硫酸溶液的物质的量浓度偏低的是__________(填序号)
①用以稀释硫酸的烧杯未洗涤
②量取浓硫酸的量筒未洗涤
③摇匀后发现液面低于刻度线再加水
④容量瓶中原有少量蒸馏水
⑤定容时观察液面俯视
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com