
题目列表(包括答案和解析)
(10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1)浓硝酸中HNO3的物质的量浓度。
(2)该合金中铜与镁的物质的量之比为 。
(3) NO2和N2O4的混合气体中,NO2的体积分数是 。

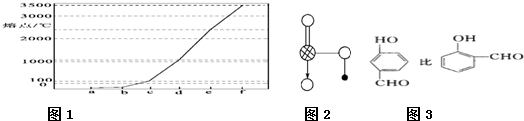
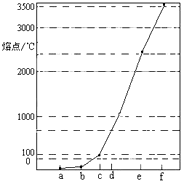 (2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.
(2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com