
题目列表(包括答案和解析)
(6分) 向50 mL浓度为18.4 mol?L-1的浓硫酸中加入过量的锌使H2SO4全部反应,生成标准状况下的气体16.8L。计算:
(1)反应中消耗的锌的质量;
(2)反应中生成的氢气的物质的量。
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |

用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中
C.将稀释后的硫酸小心地倒入容量瓶中
D.检查100 mL容量瓶口是否有漏液现象
E.将蒸馏水直接加入容量瓶,至液面距刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(1)正确的操作顺序应该是______________________________________________。
(2)进行A步操作的时候,应该选用的是________(填序号)。
①10 mL量筒;②50 mL量筒;③500 mL量筒;④1000 mL量筒
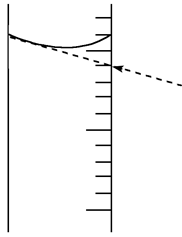
如果对装有浓硫酸的量筒读数如图所示,配制的稀硫酸的浓度将________(填“偏高”、“偏低”或“无影响”)。

(3)进行A步操作后,必须________,才能进行C步操作。
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |
用18 mol/L浓硫酸配制100 ml 3.0 mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④转移、洗涤,⑤定容、摇匀.回答下列问题:
(1)所需浓硫酸的体积是________(保留到小数点后一位),量取浓硫酸所用的量筒的规格是________(从下列中选:A.10 ml;B.25 ml;C.50 ml;D.100 ml)
(2)在上述实验步骤中,需要用到玻璃棒的有________(填序号).
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2 cm处,改用胶头滴管向容量瓶滴加至________为止.塞紧瓶塞,倒转摇匀.
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A.容量瓶用蒸馏水洗涤后残留有少量的水________
B.所用过的烧杯、玻璃棒未洗涤________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com