
题目列表(包括答案和解析)
(1)用过量锌粉与浓硫酸反应,除生成SO2外,还有 (写化学式)气体产生。(2分)
(2) 有A、B、C三种气体,A气体在一定条件下 能与O2反应生成B;B不溶于水,但易与O2反应生成C;A、C气体皆易溶于水,所得的溶液可以相互反应生成盐和水,则:
A是__________,B是_________,C是_________.(写化学式)。 (6分)
(3)0.05 mol铜与30.0mL 10.0mol?L-1的硝酸反应时,生成的产物有NO和NO2。若反应后的溶液中余有a mol H+,则反应生成的NO和NO2物质的量之和为_____ ______mol. (2分)
(2)用过量的铜片与0.2 mol浓硫酸共热足够长的时间,甲同学认为产生SO2少于0.1 mol,而乙同学认为产生SO2为0.1 mol,你支持________(填“甲”或“乙”),其理由是________________。
(2)用过量的铜片与0.2 mol 浓硫酸共热足够长的时间,甲同学认为产生SO2为0.1 mol ,理由是__________________;而乙同学认为产生SO2少于0.1 mol ,理由是___________________________。由此判断_________(填“甲”或“乙”)说的更有道理。
(1)用过量的锌粉与浓硫酸反应,某同学认为除了生成SO2外,还有氢气产生,理由是________.
(2)用过量的铜片与0.2 mol浓硫酸共热足够长的时间,甲同学认为产生SO2少于0.1 mol,而乙同学认为产生SO2为0.1 mol,你支持________(填“甲”或“乙”),其理由是________.
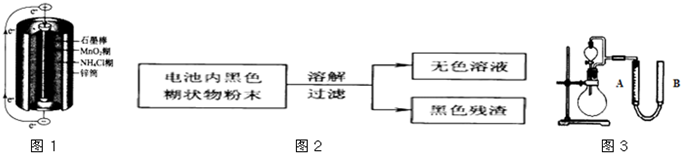
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀, 白色沉淀逐渐溶解,产生刺激性气味的气体 白色沉淀逐渐溶解,产生刺激性气味的气体 |
无色溶液中 存在Zn2+离子 |
| ② 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 |
红色石蕊试纸变蓝 红色石蕊试纸变蓝 |
无色溶液中 存在NH4+离子 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 |
黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂 MnO2做氧化剂 生成Mn2+离子 生成Mn2+离子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com