
题目列表(包括答案和解析)
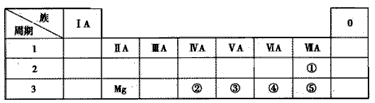
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素.请用所给元素回答下列问题.
(1)八种元素中,电负性最大的是________,D、E、G、Q四种元素第一电离能由大到小的顺序是________(填元素符号).
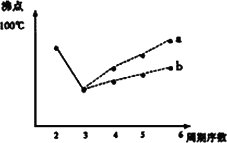
(2)两同学就M同主族的元素的氢化物的沸点的变化趋势画出了两条曲线(如下图),你认为正确的是:________(填“a”或“b”),理由是:________.
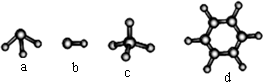
(3)A与D形成分子的空间结构可能是(填序号)________.
(4)写出T原子的基态的核外电子排布式________,TO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断TO2Cl2是________(填“极性”或“非极性”)分子.
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ⑤ | |||||
| 3 | ⑥ | ⑦ | ③ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
|
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低价 | +6 | +2 | -2 | -1 |
A.原子序数X<Y<W<Z B.纯净的X与纯净的Z反应生成XZ3
C.Z的最高正价为+6 D.HW是热稳定性最强的氢化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com