
题目列表(包括答案和解析)
在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,
下列对这四种气体的关系从大到小表达正确的是
A.体积②>③>①>④ B.密度②>③>①>④
C.质量②>③>①>④ D.氢原子个数②>④>③>①
在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2molNH3,
下列对这四种气体的关系从大到小表达正确的是
A.体积②>③>①>④ B.密度②>③>①>④
C.质量②>③>①>④ D.氢原子个数②>④>③>①
 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
 CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.| k1 |
| k2 |
| k1 |
| k2 |


在 反应中,当有6.72L(标准状况)NO产生时被还原的纯
反应中,当有6.72L(标准状况)NO产生时被还原的纯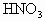 是
是
[ ]
在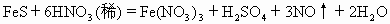 反应中,当有6.72L(标准状况)NO产生时被还原的纯
反应中,当有6.72L(标准状况)NO产生时被还原的纯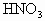 是
是
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com