
题目列表(包括答案和解析)
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。
(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
 2CO △H>0 ②N2+3H2
2CO △H>0 ②N2+3H2 2NH3 △H<0。达平衡后升温,正反应速率的变化是
2NH3 △H<0。达平衡后升温,正反应速率的变化是  2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
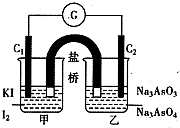 (2012?武汉模拟)已知反应“As
(2012?武汉模拟)已知反应“As| O | 3- 4 |
| O | 3- 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com