
题目列表(包括答案和解析)
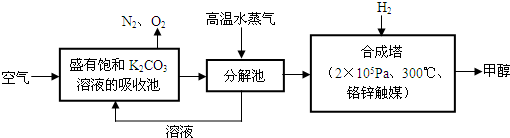
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)??? △H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g)????? △H3=-867kJ·mol-1
则△H2=???????????????? 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为??? C(s) + H2O(g)= CO(g) + H2(g),
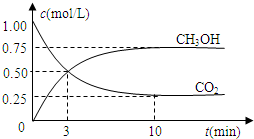
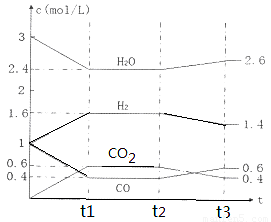
该反应的化学平衡常数表达式为K=???????????????????? 。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
a加入催化剂 ???? b降低温度?? ? c缩小容器体积 ???? d减少CO2的量
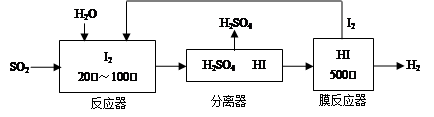
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
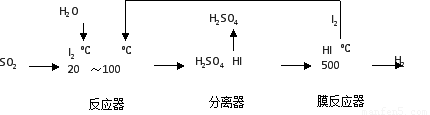
①用离子方程式表示反应器中发生的反应???????????????????????? 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是??????????????? 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

通入a气体的电极是原电池的? ??? (填“正”或“负”),
其电极反应式为? ??? ???? ????? 。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为 C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K= 。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量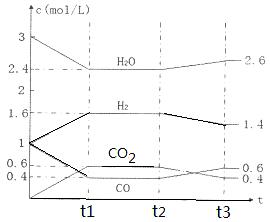
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: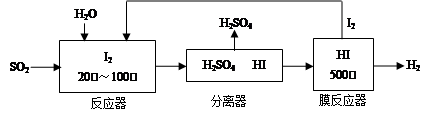
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
通入a气体的电极是原电池的 (填“正”或“负”),
其电极反应式为 。
 CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。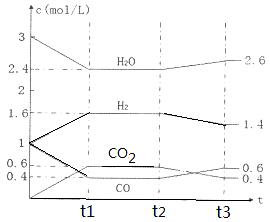

| ||
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com