
题目列表(包括答案和解析)
| ||
| ||
| ||
| △ |
| ||
| △ |

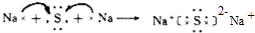
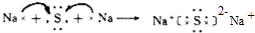
| 1 |
| 2 |
| 1 |
| 2 |
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是:
(用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是 ,
反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+ 离子半径逐渐减小;化合物XN常温下为气体,据此回答:
(1)写出Z与N形成化合物的电子式 。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式: 。
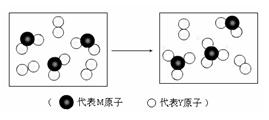
(3)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示:
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com