
题目列表(包括答案和解析)
实验方案 | 实验现象 |
①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞试液 | A.浮于水面,溶成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的饱和Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,有气体产生 |
④镁带与稀盐酸反应 | D.剧烈反应,有气体产生 |
⑤铝条与稀盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:______________________________________________________。
(2)实验用品:仪器:①____________ ②____________ ③____________
④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片 ⑧砂纸 ⑨火柴
药品:钠、镁带、铝条、稀盐酸、新制氯水、饱和Na2S溶液、AICl3溶液、氢氧钠溶液、酚酞试液。
(3)实验内容:(填写与实验方案相对应的实验现象和有关化学反应的离子方程式
实验方案 | 实验现象(填写字母) | 离子方程式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
|
⑥ |
|
|
(4)实验结论:___________________________________________________________。
请从原子结构理论方面简单说明具有上述结论的原因_________________________。
(5)请你补充一个实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
_____________________________________________________________________。
| 实验 编号 |
KClO3/g | 氧化物 | 产生气体/mL (已折算到标况) |
耗时/s | ||
| 化学式 | 质量/g | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 90% | 67.2 | 188.3 |
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
 (3)铁在元素周期表中的位置是 。
(3)铁在元素周期表中的位置是 。
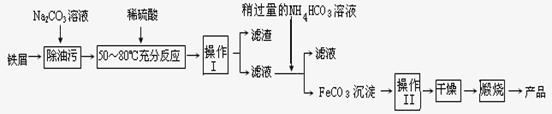
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____ 、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。 a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容; b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。
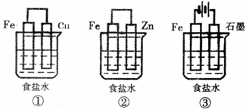
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为
。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为
FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
(3)铁在元素周期表中的位置是 。
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
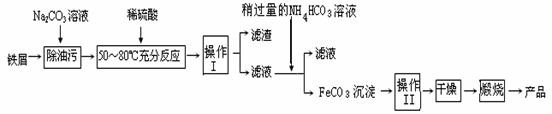
①操作Ⅰ、Ⅱ的名称分别是__ __ 、__ __。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ?? ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ?? ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ?? 。
(2)当n=2时,B原子的结构示意图为 ?? ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ?? ,该晶体中最小的环共有 ?? 个微粒构成,微粒间的作用力是 ?? 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ?? ,A、B、C、D四种元素的第一电离能由大到小的顺序是
?? (用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
| 现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ?? 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ?? (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ?? (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ?? ,原因是 ?? 。
b. ?? ,原因是 ?? 。
c. ?? ,原因是 ?? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com