
题目列表(包括答案和解析)
(1)(4分)试设计一个原电池,使之发生的总反应方程式为:CuSO4+Fe=FeSO4+Cu,画出简易装置图(要求标出正负极材料名称和电解质溶液),写出正、负极电极反应式 。
(2)(6分)现有如下材料和试剂:锌片、镁片、铁片、铝片、铜片、若干导线、电流计,稀硫酸、浓硝酸、稀盐酸、浓盐酸、硫酸铜溶液。
要求:设计一个原电池,铜做负极。则该原电池的正极材料可以选用以上所给的哪种金属 ;
电解质溶液可选用 ;
电池的总化学反应方程式 。
 CH
CH 。三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:_________________。
。三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:_________________。 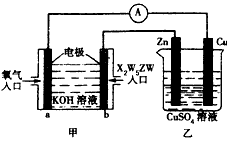
 CH
CH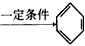 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。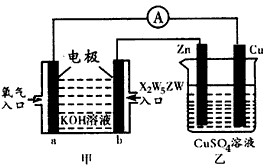
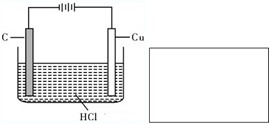 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.
| ||
| ||
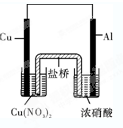

| ||
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH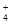 | SO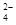 | NO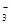 | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
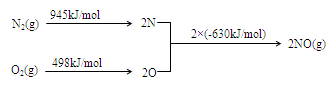
 2NO(g)△H= 。
2NO(g)△H= 。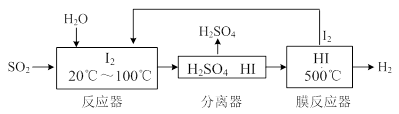
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com