
题目列表(包括答案和解析)
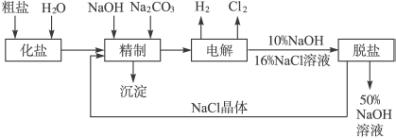
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为___________________。与电源负极相连的电极附近溶液Ph_________(填“不变”“升高”或“降低”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为______________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该试剂可以是_____________。
,该试剂可以是_____________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为___________(选a、b、c)。
,加入试剂的合理顺序为___________(选a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过___________、冷却、_________(填写操作名称)除去NaCl。
(6)在用阳离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,可防止Cl2与NaOH反应。采用无隔膜电解冷的食盐水时,Cl2与NaOH充分反应,产物最终仅有NaClO和H2,相应的化学反应方程式为___________________________、_______________________。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: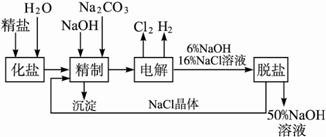
依据上图,完成下列填空:
(1)工业食盐中含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为 ___________________________,___________________________。
(2)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是________________。
,该钡试剂可以是________________。
a.Ba(OH)2?b.Ba(NO3)2?c.BaCl2
(3)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为____________。
,加入试剂的合理顺序为____________。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______________、冷却、______________除去NaCl。(填写操作名称)
(5)电解食盐水时,总的反应方程式为____________________________。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为____________________________。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: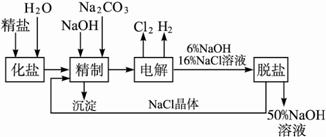
依据上图,完成下列填空:
(1)工业食盐中含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为 ___________________________,___________________________。
(2)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是________________。
,该钡试剂可以是________________。
a.Ba(OH)2?b.Ba(NO3)2?c.BaCl2
(3)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为____________。
,加入试剂的合理顺序为____________。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______________、冷却、______________除去NaCl。(填写操作名称)
(5)电解食盐水时,总的反应方程式为____________________________。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为____________________________。
(1)如图是离子交换膜法电解饱和食盐水示意图。电解槽阳极产生的气体是____________;NaOH溶液的出口为___________(填字母);精制饱和食盐水的进口为___________(填字母);干燥塔中应使用的液体是___________。

(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为____________________________________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在
3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为___________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气。现制得氯酸钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com