氨在国民经济中占有重要的地位,请参与下列探究.
(1)合成氨反应N
2(g)+3H
2(g)?2NH
3(g),该反应为放热反应,若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H
不改变
不改变
(填“增大”“减小”或“不改变”).
(2)已知在400℃时,N
2(g)+3H
2(g)?2NH
3(g)的K=0.5,则①2NH
3(g)?N
2(g)+3H
2(g)的K=
2
2
(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N
2、H
2、NH
3的物质的量分别为4mol、2mol、4mol;则此时反应v(N
2)
正=
=
v(N
2)
逆(填:“>”、“<”、“=”或“不能确定”)
(3)在三个相同容器中各充入1 molN
2和3molH
2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是
D
D
(填序号).
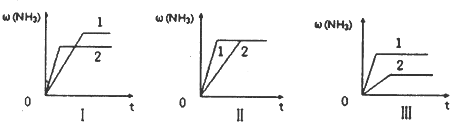
A.图Ⅰ可能是不同压强对反应的影响,且P
2>P
lB.图Ⅱ可能是不同压强对反应的影响,且P
l>P
2C.图Ⅲ可能是不同温度对反应的影响,且T
1>T
2D.图Ⅱ可能是同温同压下,催化剂性能,1>2.


 如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )