
题目列表(包括答案和解析)
| 方案 | 操作 | 结论 |
| 甲 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 乙 | ||
| 丙 | ||
| 丁 |
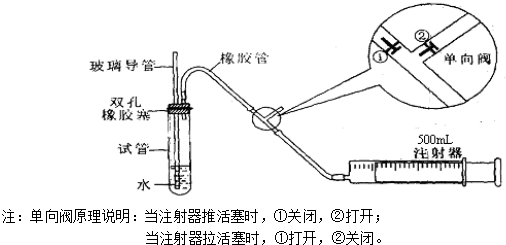
| 分组 | 第一小组 | 第二小组 |
| 抽气时间 | 20分钟 | 21分钟 |
| 抽气次数 | 100 | 130 |
| SO2含量mg/m3 |
发生离子反应的条件之一是生成气体,请讨论这一自发反应的原因:_________.并继续思考能用此原因解释离子反应生成沉淀的情况吗?________________.
【提出猜想】同学们对溶液中Fe3+和![]() 之间的反应进行了猜想,提出了如下观点:
之间的反应进行了猜想,提出了如下观点:
Ⅰ、认为发生相互促进的水解反应,其离子反应方程式为:
2Fe3++3![]() +6H2O
+6H2O![]() 2Fe(OH)3(胶体)+3H2SO3
2Fe(OH)3(胶体)+3H2SO3
Ⅱ、认为发生氧化还原反应,其离子反应方程式为:
2Fe3++![]() +H2O
+H2O![]() 2Fe2++2H++
2Fe2++2H++![]()
【实验验证】为验证“猜想”,同学们实验如下:
(1)取一定量的Na2SO3固体配成Na2SO3浓溶液。
(2)取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,溶液颜色先由黄色变为红棕色,但无气泡产生,无沉淀生成;继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变成红褐色溶液。
(3)换用稀释的FeCl3和Na2SO3溶液重复上述实验,产生的现象完全相同。
(4)为判断红褐色溶液中含有Fe(OH)3从而证明猜想Ⅰ正确。①部分同学认为只要证明该体系为胶体即可,因此通过_____________现象设计实验方案,证明了其为Fe(OH)3胶体;
②部分同学从反证法的角度考虑,认为只要证明红褐色溶液中仍然有+3价的铁,可说明Fe3+没有被还原为Fe2+则猜想Ⅱ不正确,设计方案为,观察到,从而说明红褐色溶液中含有+3价的铁。
(5)另有部分同学认为只要证明红褐色溶液中含有![]() 可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
【解释结论】综合(4)(5)考虑,Fe3+与![]() 的反应类型为_____________。
的反应类型为_____________。
【实验反思】某学同认为(5)中![]() 来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
【拓展探究】鉴于Na2CO3在组成上与Na2SO3相似,某同学在FeCl3溶液中加入Na2CO3溶液,马上观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是_____________;同学们交流后认为二者水溶液与氯化铁溶液反应的现象差别很大,除![]() 有较强的还原性而
有较强的还原性而![]() 没有还原性的原因外,还可能有的原因是__________________________。
没有还原性的原因外,还可能有的原因是__________________________。
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是
____________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 现象 |
| | |
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
| 操作 | 现象 |
| | |
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com