
题目列表(包括答案和解析)
现有A.B.C.D四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布。A没有正价态的化合物;B的氢化物化学式为![]() ,0.2mol的C原子能从酸中置换产生2.24L
,0.2mol的C原子能从酸中置换产生2.24L ![]() (S.T.P.)。 D的原子核中没有中子。
(S.T.P.)。 D的原子核中没有中子。
(1)根据以上条件,计算、推断A.B.C.D的元素名称。
(2)用电子式表示C与A, B与D,C与B(加热条件下),相互结合成的化合物,指出其化学键类型及化合物的类型。
现有A、B、C、D四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布。A没有正价态的化合物;B的氢化物分子式为H2B,0.2mol的C原子能从酸中置换产生2.24LH2(S.T.P)。D的原子核中没有中子。
(1)根据以上条件,推断A、B、C、D的元素名称。
(2)用电子式表示C与A,C与B,B与D相互结合成化合物的过程,指出其化合物的类型及化学键类型。
(3)写出C与B所形成的化合物跟D与B所形成的化合物作用的离子方程式。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
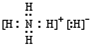
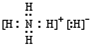
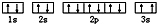 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com