
题目列表(包括答案和解析)
| ||
| ||
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 最外层电子数是次外层电子数的2.5倍 |
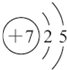
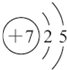
| ||
| ||
| ||
| ||




| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |


|
已知0.4 mol液态肼(N2H4)与足量的液态H2O2反应,生成氮气和水蒸气,放出256.65 kJ的热量,则下列热化学方程式正确的是 | |
| [ ] | |
A. |
N2H4+2H2O2 N2+4H2O;△H=-641.63 kJ mol-1 |
B. |
N2H4(l)+2H2O2(l) N2(g)+4H2O(l);△H=-641.63 kJ mol-1 |
C. |
N2H4(l)+2H2O2(l) N2(g)+4H2O(g);△H=-641.63 kJ mol-1 |
D. |
N2H4(l)+2H2O2(l) N2(g)+4H2O(g);△H=-256.65 kJ mol-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com