
题目列表(包括答案和解析)
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂:

已知酯与醇可发生如下酯交换反应:

(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
A的结构简式是__________________;A中所含官能团的名称是____________________。
丙烯→A的反应类型是_______________;A→C3H5Br2CI的反应类型是_____________。
(2)A水解可得到D.该水解反应的化学方程式为:
_______________________________________________________________________.
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,S中各元素的质量分数分别为:碳60%,氢8%,氧32%. S的结构简式为_________________________________.
(4)下列说法正确的是______________(填字母代号)。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是__________________。
(6)F的分子式为C10H10O4. 。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。足量D和F反应生成DAP单体的化学方程式为:
_______________________________________________________________________.
(7)实验室由2-丙醇制备丙烯时,还产生少量SO2、 CO2 及水蒸气,某同学用以下试剂
检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)。
①饱和Na2SO3溶液②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂:
已知酯与醇可发生如下酯交换反应: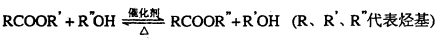
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
A的结构简式是__________________;A中所含官能团的名称是____________________。
丙烯→A的反应类型是_______________;A→C3H5Br2CI的反应类型是_____________。
(2)A水解可得到D.该水解反应的化学方程式为:
_______________________________________________________________________.
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,S中各元素的质量分数分别为:碳60%,氢8%,氧32%. S的结构简式为_________________________________.
(4)下列说法正确的是______________(填字母代号)。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是__________________。
(6)F的分子式为C10H10O4. 。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。足量D和F反应生成DAP单体的化学方程式为:
_______________________________________________________________________.
(7)实验室由2-丙醇制备丙烯时,还产生少量SO2、 CO2及水蒸气,某同学用以下试剂
检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)。
①饱和Na2SO3溶液②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(14分)某学校研究性学习小组利用实验室常用试剂,
探究硝酸的氧化性。请完成下面的空白:
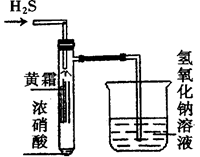
(1)在具支试管底部滴入5滴浓硝酸,然后用硫化 亚铁与盐酸反应制备H2S气体,如图所示通入具支试管中,可以观察到在试管内形成黄烟,黄烟附着在试管内壁上,形成“黄霜”。

① 出上述制备H2S的离子方程式
______________________________________。
②在试管内壁上的“黄霜”的成分是_______________,该反应说明浓硝酸有氧化性外,实验现象还说明了浓硝酸具有________性。该实验中烧杯内的氢氧化钠溶液的作用是
__________________________________________________________________。
(2)卤族元素单质也具有氧化性,该小组设计了下面的实验探究碘单质与稀硝酸氧化性强弱比较:
①提出合理的假设
假设l:碘单质氧化性强于稀硝酸;假设2:碘单质氧化性弱于稀硝酸。
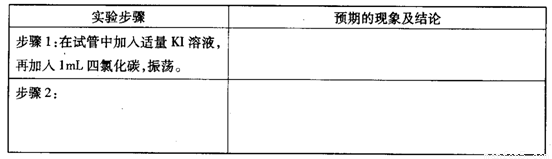
②设计实验方案,进行实验探究,请写出实验步骤和预期的现象与结论。限选实验试剂与仪器:稀硝酸、KI溶液、四氯化碳;试管、胶头滴管。

(14分)某学校研究性学习小组利用实验室常用试剂,
探究硝酸的氧化性。请完成下面的空白:
(1)在具支试管底部滴入5滴浓硝酸,然后用硫化 亚铁与盐酸反应制备H2S气体,如图所示通入具支试管中,可以观察到在试管内形成黄烟,黄烟附着在试管内壁上,形成“黄霜”。
① 出上述制备H2S的离子方程式
______________________________________。
②在试管内壁上的“黄霜”的成分是_______________,该反应说明浓硝酸有氧化性外,实验现象还说明了浓硝酸具有________性。该实验中烧杯内的氢氧化钠溶液的作用是
__________________________________________________________________。
(2)卤族元素单质也具有氧化性,该小组设计了下面的实验探究碘单质与稀硝酸氧化性强弱比较:
①提出合理的假设
假设l:碘单质氧化性强于稀硝酸;假设2:碘单质氧化性弱于稀硝酸。
②设计实验方案,进行实验探究,请写出实验步骤和预期的现象与结论。限选实验试剂与仪器:稀硝酸、KI溶液、四氯化碳;试管、胶头滴管。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com