
题目列表(包括答案和解析)
 键的数目为____ __________________.
键的数目为____ __________________. g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为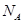 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含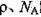 的计算式表示)
的计算式表示)
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
31 |
30 |
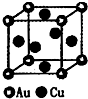
| 2 |
| 3 |
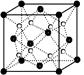
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com