下表为长式周期表的一部分,其中的编号代表对应的元素.
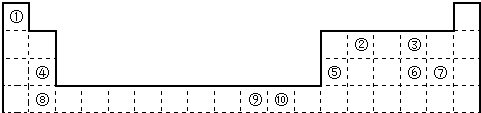
请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).

(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3
MgCNi3
(用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp
2杂化
(4)某元素的特征电子排布式为ns
nnp
n+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的分子X构形为
三角锥型
三角锥型
;X在①与③形成的分子Y中的溶解度很大,其主要原因是
NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
.
(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
1s22s22p63s2
1s22s22p63s2
.
| 电离能/kJ?mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d
0或d
10排布时,无颜色;为d
1~d
9排布时,有颜色,如[Co(H
2O
6]
2+显粉红色.据此判断,[Mn(H
2O
6]
2+有
有
颜色(填“无”或“有”).


