盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO
4?7H
2O的实验过程如下:

已知:①Ksp[Mg(OH)
2]=6.0×10
-12.②Fe
2+、Fe
3+、Al
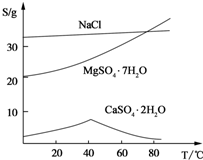
3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如下图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是
提高Mg2+的浸取率
提高Mg2+的浸取率
(2)若溶液中Mg
2+的浓度为6.0mol?L
-1,则溶液pH≥
8
8
才可能产生Mg(OH)
2沉淀.
(3)第二次过滤需要趁热进行,主要原因是
温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可)
温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可)
,所得滤渣的主要成分是
Al(OH)3、Fe(OH)3、CaSO4?2H2O
Al(OH)3、Fe(OH)3、CaSO4?2H2O
.
(4)从滤液Ⅱ中获得MgSO
4?7H
2O晶体的实验步骤依次为:①向滤液Ⅱ中加入
NaOH溶液
NaOH溶液
;②过滤,得沉淀;③
向沉淀中加足量稀硫酸
向沉淀中加足量稀硫酸
;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品.
(5)若获得的MgSO
4?7H
2O的质量为24.6g,则该盐泥中镁[以Mg(OH)
2计]的百分含量约为
20.0%
20.0%
(MgSO
4?7H
2O的相对分子质量为246).