
题目列表(包括答案和解析)
| 序号 | 操 作 | 现 象 | 结 论 |
| ① | 在第一份溶液中取少量放入试管中,滴加几滴酚酞溶液. | 溶液变红 | 溶液中一定有氢氧化钠 |
| ② | 将第二份溶液放入试管中,加入足量澄清石灰水. | 生成白色沉淀 | 溶液中一定有碳酸钠 |
| ③ | 将②所得溶液过滤,将固体洗涤、干燥、称重 | 沉淀质量5克 | 原来通入的CO2气体体积在标况下为2.24L |
| 序号 | 结论是否正确 | 理 由 |
| ① | 不正确 不正确 |
因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 |
| ② | 不正确 不正确 |
因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 |
| ③ | 正确 正确 |
碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L 碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L |
| 实验编号 | 1 | 2 | 3 |
| 消耗Na2S2O3体积/mL | 26.90 | 27.00 | 26.96 |

(11分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 。若其它操作不变,将A与C连接,可观察到的现象是 。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是 (写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
| 实验操作 | 实验现象 | 结论 | |
| ① 取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
| |
| ② 过滤,取2 mL滤液于试管中 | |||
| ③ |
|
| |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。反应I为:
NaCl+CO2+NH3+H2ONaHCO3↓+NH4Cl,处理母液的两种方法如下。
① 向母液中加入石灰乳,可将其中 循环利用,同时得到融雪剂 。
② 向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。
纯碱、烧碱等是重要的化工原料。
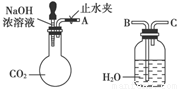
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
A.NaOH和Na2CO3;
B. ;
C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
|
实验操作 |
实验现象 |
结论 |
|
(1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
|
|
(2) |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com