
题目列表(包括答案和解析)
2- 4 |
2- 4 |

2- 4 |
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
+ 4 |
- 3 |
+ 4 |
- 3 |
- 3 |
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题.
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.
(Ⅲ)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用.
①写出步骤(I)反应的化学方程式:________
②写出步骤(Ⅲ)反应的离子方程式:________
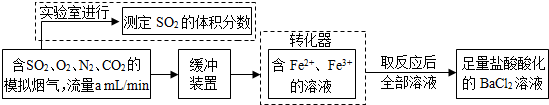
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用.某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率.
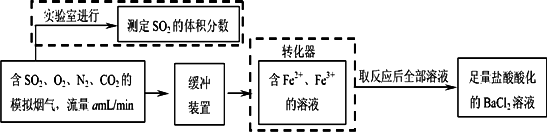
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)________.(参考:还原性SO2>I->Br->Cl-)
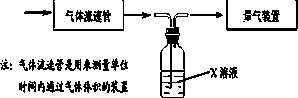
A.碘的淀粉溶液
B.酸性高锰酸钾溶液
C.氢氧化钠溶液
D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是________和加入盐酸酸化的氯化钡溶液后生成沉淀的质量.
(3)
为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为
两种无毒气体.请写出加入甲醇后反应的离子方程式________.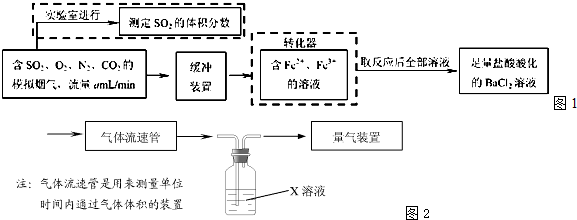
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |


 Sx、CO+
Sx、CO+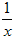 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx。其中COS中“C”化合价为__________。
Sx。其中COS中“C”化合价为__________。Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO![]() 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是 mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH= (已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、 、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为 g.(用含a的式子表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com