
题目列表(包括答案和解析)
| 编号 | 实验步骤 | 实验现象 | 化学方程式 | ||||||||
| ① | 将一小块钠放入滴有 酚酞溶液的冷水中 |
钠浮在水面上,熔成闪亮 的小球,四处游动,发出 嘶嘶的声音,最后消失, 溶液变为红色 |
2Na+2H2O=2NaOH+H2↑ | ||||||||
| ② | 将镁条用砂纸打磨 后,放入冷水中,滴 入几滴酚酞试液,然 后加热至沸腾; |
与冷水反应缓慢;加热煮沸有气体产生,溶液变为浅红色 | Mg+2H2O
Mg+2H2O
| ||||||||
| ③ | 将镁条投入稀盐酸中 | 强烈反应,迅速产生大量无色气体 | Mg+2HCl=MgCl2+H2↑ | ||||||||
| ④ | 将铝条投入稀盐酸中 | 比镁反应的速率慢一些,产生气体 | 2Al+6HCl=2AlCl3+3H2↑ 2Al+6HCl=2AlCl3+3H2↑ |
(11分)某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律:1、同一周期内从左到右元素金属性的递变规律;
2、同一主族内从上到下元素非金属性的递变规律。
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴加酚酞。 | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞。镁带用砂纸打磨后与2mol/L盐酸反应。 | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| | 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | ||||||
| Ⅰ | | | | | | | | |
| Ⅱ | | | | | | | | |
某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:

(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
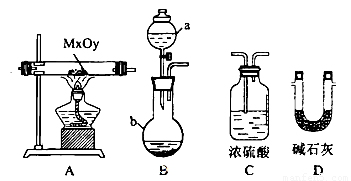
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________(用含X、y、m、n的式子表示)。
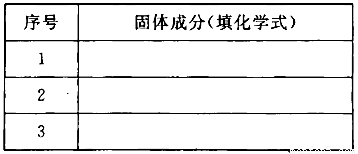
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。
(11分)某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律:1、同一周期内从左到右元素金属性的递变规律;
2、同一主族内从上到下元素非金属性的递变规律。
|
实验方法(Ⅰ) |
实验现象(Ⅱ) |
|
1.钠与冷水反应,再向反应后溶液中滴加酚酞。 |
A.产生白烟 |
|
2.向新制的H2S饱和溶液中滴加新制的氯水 |
B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
|
3.镁带用砂纸打磨后在空气中燃烧 |
C.产生大量气泡、气体可以燃烧 |
|
4.NaI溶液中加入溴水和CCl4 |
D.下层溶液变橙色 |
|
5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞。镁带用砂纸打磨后与2mol/L盐酸反应。 |
E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
|
6.蘸浓氨水与浓盐酸的两玻璃棒接近 |
F.下层溶液变紫色 |
|
7.NaBr溶液中加入氯水和CCl4 |
G.发出耀眼的强光,生成白色物质 |
|
8.铝片用砂纸打磨后与2mol/L盐酸反应 |
H.生成淡黄色沉淀 |
回答下列问题:
(1) 从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
|
|
探究同一周期从左到右元素金属性的递变规律 |
探究同一主族内从上到下元素非金属性的递变规律 |
||||||
|
Ⅰ |
|
|
|
|
|
|
|
|
|
Ⅱ |
|
|
|
|
|
|
|
|
(2)实验结论(用元素符号表示具体的强弱顺序):
元素的金属性: ,元素的非金属性: 。
(3)上表(Ⅰ)中实验方法8反应的离子方程式
(4)上表(Ⅱ)中实验现象D反应的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com