
题目列表(包括答案和解析)

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
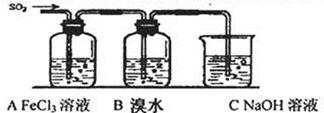
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。

(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
|
n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
|
方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
|
方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。

(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
|
n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
|
方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
|
方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
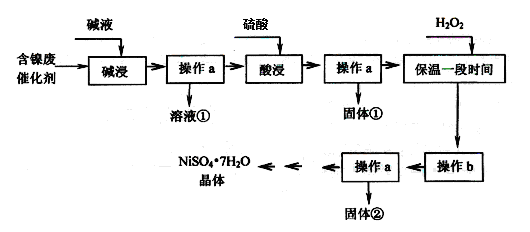
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
4.1 |
1.7 |
7.6 |
7.0 |
|
完全沉淀的pH |
5.2 |
3.2 |
9.5 |
9.2 |
回答下列问题:
(1)操作a为 。
(2)“碱浸”的目的是除去 (填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式 。
②已知碱性镍氢电池总反应:
H2+2NiOOH 2Ni(OH)2
,写出该反应放电时正极反应式
。
2Ni(OH)2
,写出该反应放电时正极反应式
。
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com