
题目列表(包括答案和解析)
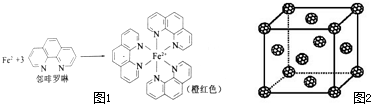 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.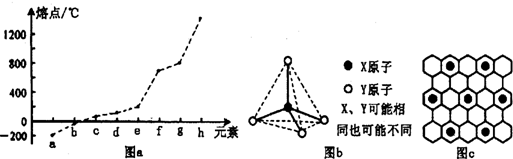
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
| 氢化物 | 沸点℃ |
| A | 1317 |
| B | 100 |
| C | 19.5 |
| D | -33 |
| E | -162 |
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
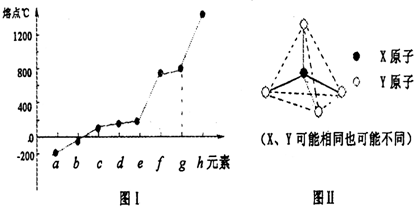
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为________________;第三周期元素单质的熔点(℃)变化如下图Ⅰ所示,其中h的元素符号为________________。
氢化物 | 沸点/℃ |
A | 1 317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |
表1

图Ⅰ
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式_________________。

(X、Y可能相同也可能不同)
图Ⅱ
(4)第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为__________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com