
题目列表(包括答案和解析)
氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是___________(选填①游离态②化合态③不确定)
(2)以下变化属于化学变化的是__________________________:
① 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式_____________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式__________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为____________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_______________________
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为_______________。
氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是___________(选填①游离态②化合态③不确定)
(2)以下变化属于化学变化的是__________________________:
① 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式_____________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式__________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为____________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_______________________
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为_______________。
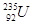 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐X、Y、Z为三种短周期元素,他们在周期表中的位置关系如图所示 。据此回答下列问题:
。据此回答下列问题:
(1)X元素的名称为 ,它形成的单质为 (用分子式表示); He 。若该元素的某种原子内核内中子数与质子数相等,则该原子的摩尔质量是 ;结合最近卫星发回的图片预测,月球的土壤中吸附着数百万吨的![]() ,上述原子与
,上述原子与![]() 的关系是 。
的关系是 。
(2)Y元素形成单质的电子式是 ,Y单质的氧化性 (填“强于”或者“弱于”)O2的氧化性,并用相应的化学方程式说明 。
(3)元素Z在自然界中的存在形态为 (填序号)①只有化合态,②只有游离态,③既有游离态,又有化合态;含Z元素的某些化合物燃烧后会造成严重的大气污染,其主要原因是 。
(4)Y元素、Z元素与H2化合时的能量变化是 ,(填“都放热”、“都吸热”、“前者放热,后者吸热”或者“前者吸热,后者放热”),能量变化的大小关系为前者 (填“>”、“=”或者“<”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com