
题目列表(包括答案和解析)

| ||
| ||
| 第一次B中溶液含有离子 | 第二次B中溶液含有离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO 42- |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO 42- |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
氯磺酸是无色液体,沸点约152℃,具有强腐蚀性,易水解,遇湿空气发出强烈的白雾,它属于危险品.制取氯磺酸的典型反应HCl(g)+SO3(发烟硫酸)=HSO3Cl(1)是在常温下进行的.在实验室里制取氯磺酸可用图中的仪器装置(图中夹持、固定仪器等已略去):

用到的试剂有:①浓盐酸,②浓硫酸,③发烟硫酸,④无水氯化钙,⑤稀氢氧化钠溶液.制备时要在常温下使干燥的氯化氢气和三氧化硫反应,至不能吸收HCl时表明氯磺酸已大量制得,然后在干HCm气氛中分离出氯磺酸.
(1)装置A中的毛细管不断地均匀放出浓盐酸到圆底烧瓶的底部,制取氯化氢气体,这是利用了浓硫酸的什么性质?________.
(2)仪器中应盛入的试剂(填数码);B________,C________,F________.
(3)实验过程中何时需要加热________,应在哪个装置下用酒精灯加热________(填代码字母).
(4)如若不加F装置可能发生的现象是________,原因是________.
(5)在F之后应还有什么装置________,其作用是________.
氯磺酸是无色液体,密度1.79g·![]() ,沸点约152℃,氯磺酸有强腐蚀性,遇湿空气发出强烈的白色烟雾,它属于危险品,制取氯磺酸的典型反应是在常温下进行的:
,沸点约152℃,氯磺酸有强腐蚀性,遇湿空气发出强烈的白色烟雾,它属于危险品,制取氯磺酸的典型反应是在常温下进行的:![]() ,在实验室里制取氯磺酸可用如下图所示的仪器装置(下图中夹持、固定仪器等已略去.)
,在实验室里制取氯磺酸可用如下图所示的仪器装置(下图中夹持、固定仪器等已略去.)

用到的试剂、药品有:①密度1.19g·![]() 浓盐酸,②密度1.84g·
浓盐酸,②密度1.84g·![]() 、质量分数为98.3%的浓硫酸,③发烟硫酸,④无水氯化钙,⑤水.制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收
、质量分数为98.3%的浓硫酸,③发烟硫酸,④无水氯化钙,⑤水.制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收![]() 时表示氯磺酸已大量制得,其后在干燥的
时表示氯磺酸已大量制得,其后在干燥的![]() 气氛中将氯磺酸分离出来.
气氛中将氯磺酸分离出来.
(1)仪器中应盛入的试剂与药品.A中的a________,b_________,C__________,F________.
(2)A中的分液漏斗下端接有的毛细管是重要部件,在发生气体前要把它灌满a中的液体,在发生气体时要不断地均匀放出液体,这是因为____________________________.
(3)实验过程中何时需要加热___________________________________;应在何种装置下面用酒精灯加热(填代码字母)________.
(4)如果不加F装置可能发生的现象是____________,有关的化学反应方程式为________________________.
(5)在F装置后还应加什么装置?______________________,其作用是_______.
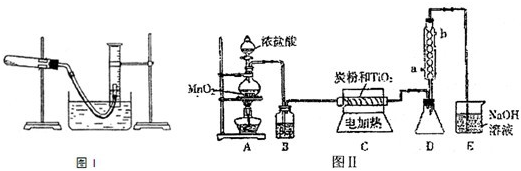
| ||
| ||
| 编号 | 装置的缺陷和不妥之处 |
| a | TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 |
| b | TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 |
| … | 由于CO气体有毒,缺少CO的处理装置 由于CO气体有毒,缺少CO的处理装置 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com