
题目列表(包括答案和解析)
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |

化学反应原理在工业生产中具有十分重要的意义。
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式 。还可以由天然气或重油制取氢气:CH4+H2O(g) 高温催化剂CO+3H2;比较以上两种方法转移6mol电子时,C和CH4的质量之比是 。
(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
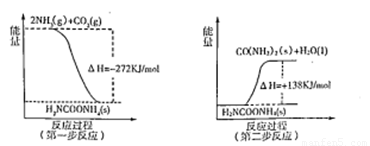
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(3)已知反应Fe(s)+CO2(g)=FeO(s)+CO(g) △H=akJ/mol。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
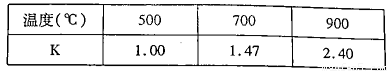
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“:”)。在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5min后达到平街时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填字母)。
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃ D.使用合适的催化剂
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL)(标准状况) |
50 |
120 |
232 |
288 |
310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。

化学反应原理在工业生产中具有十分重要的意义。
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式 。还可以由天然气或重油制取氢气:CH4+H2O(g) 高温催化剂CO+3H2;比较以上两种方法转移6mol电子时,C和CH4的质量之比是 。
(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(3)已知反应Fe(s)+CO2(g)=FeO(s)+CO(g) △H=akJ/mol。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“:”)。在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5min后达到平街时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com