
题目列表(包括答案和解析)
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:

(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_______。
(2)加入溶液W的目的是______。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时,使用的试剂为_____。
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是______。

(4)工业规模海水提溴常用空气吹出法将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,请写出该反应的离子方程式: 。
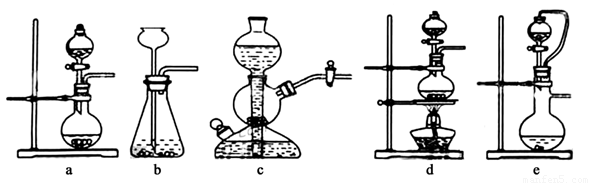
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 (填写字母)。
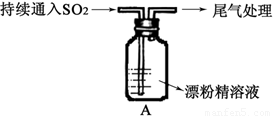
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是 。
(2)③中大量白色沉淀的成份是 。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是 。
(4)用离子方程式解释现象③中黄绿色褪去的原因: 。
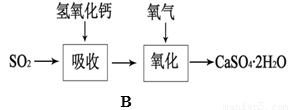
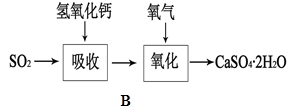
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
。
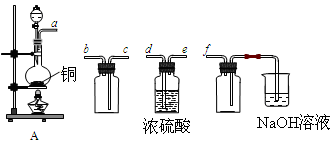
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。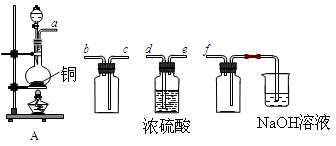
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
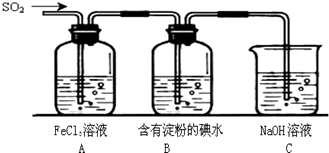
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: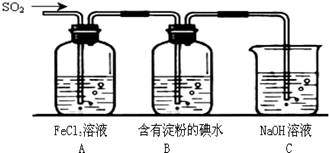
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 (填写字母)。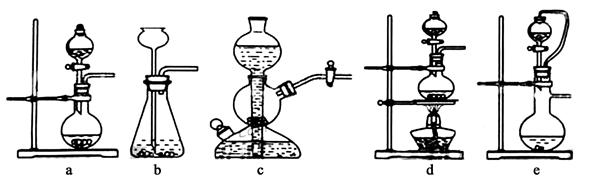
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是 。
(2)③中大量白色沉淀的成份是 。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是 。
(4)用离子方程式解释现象③中黄绿色褪去的原因: 。
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
。
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com