
题目列表(包括答案和解析)
以下各化学反应方程式错误的是
A.2AgF+CaCl2=2AgCl↓+CaF2↓
B.FeS+2HNO3=Fe(NO3)2+H2S↑
C.MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
D.2Na2O2+2H2O=4NaOH+O2↑
下列说法错误的是
A.热化学方程式各物质前的化学计量数不表示分子个数只代表物质的量
B.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
C.许多化学反应的反应热可以直接测量,其测量仪器叫做量热计
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
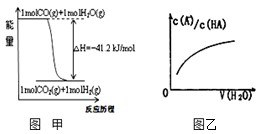 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
关于下列各图的叙述错误的是 ( )
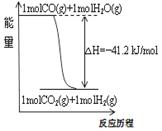 |

| 化学方程式 | 平衡常数K |
| F2+H2 | 6.5×1095 |
| Cl2+H2 | 2.6×1033 |
| Br2+H2 | 1.9×1019 |
| I2 + H2 | 8.7×102 |
图 甲 表 乙 图 丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com