
题目列表(包括答案和解析)
(14分)目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极。在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流。
(1)水煤气成分是 。水煤气又称为合成气,在一定条件下可以合成二甲基醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是 。
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为 。
(3)下图是丙烷、二甲醚燃烧过程中能量变化图,
其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式
若以第⑵问中陶瓷电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有 10.8g银析出,试求制备水煤气时, 至少需要碳 g
(14分)目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极。在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流。
(1)水煤气成分是 。水煤气又称为合成气,在一定条件下可以合成二甲基醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是 。
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为 。
(3)下图是丙烷、二甲醚燃烧过程中能量变化图,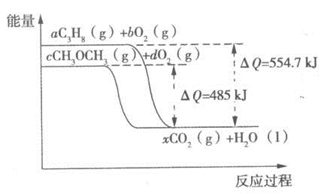
其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式
若以第⑵问中陶瓷电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有 10.8g银析出,试求制备水煤气时, 至少需要碳 g
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O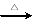 乙+丙??? b.乙
乙+丙??? b.乙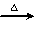 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:???????????????????????????
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是:??????????????? ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为????????? (选填编号).
A.3 mL??? B.7.5 mL? C.15 mL??? D.27.5 mL
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为??????????????????????? 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式????????????????????????????????? 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为??????????????????
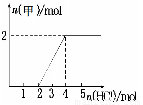
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为????????????????????????????????????? 。
(14分)目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极。在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流。
(1)水煤气成分是 。水煤气又称为合成气,在一定条件下可以合成二甲基醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是 。
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为 。
(3)下图是丙烷、二甲醚燃烧过程中能量变化图,

其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式
若以第⑵问中陶瓷电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有 10.8g银析出,试求制备水煤气时, 至少需要碳 g
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O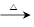 乙+丙 b.乙
乙+丙 b.乙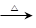 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
 丙。则:
丙。则:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com