
题目列表(包括答案和解析)
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。

请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。

①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
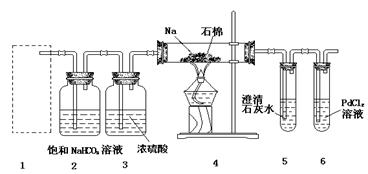
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧,为了确定其生成产物并进行实验论证。某同学设计了下图所示装置进行实验(已知PdCl2能被CO还原得到黑色的Pd),请回答下列问题:
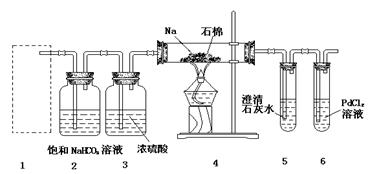
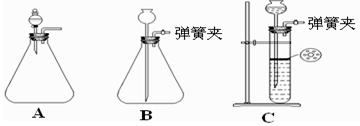
(1)为使反应随开随用,随关随停,方框内应选用下图所示 装置(填字母代号)。
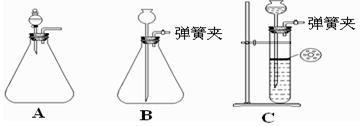
(2)实验室制取二氧化碳气体宜用的药品是 (填标号)。
①石灰石,②纯碱,③小苏打,④18.4 mol·L—1硫酸,⑤11.2mol·L—1盐酸,⑥蒸馏水,⑦木炭粉。
(3)在2装置内进行反应的离子方程式为 。检查装置气密性并装好药品后,点燃酒精灯之前待装置 (填数字编号)中出现 现象时,再点燃酒精灯。
(4)①若装置6中有黑色沉淀,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 ;
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧,为了确定其生成产物并进行实验论证。某同学设计了下图所示装置进行实验(已知PdCl2能被CO还原得到黑色的Pd),请回答下列问题:
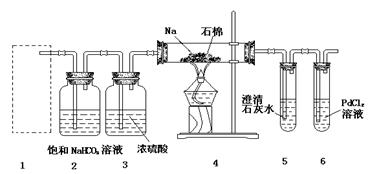
(1)为使反应随开随用,随关随停,方框内应选用下图所示 装置(填字母代号)。
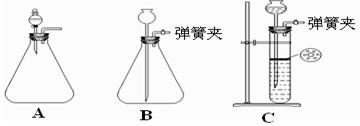
(2)实验室制取二氧化碳气体宜用的药品是 (填标号)。
①石灰石,②纯碱,③小苏打,④18.4 mol·L—1硫酸,⑤11.2mol·L—1盐酸,⑥蒸馏水,⑦木炭粉。
(3)在2装置内进行反应的离子方程式为 。检查装置气密性并装好药品后,点燃酒精灯之前待装置 (填数字编号)中出现 现象时,再点燃酒精灯。
(4)①若装置6中有黑色沉淀,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 ;
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧,为了确定其生成产物并进行实验论证。某同学设计了下图所示装置进行实验(已知PdCl2能被CO还原得到黑色的Pd),请回答下列问题:
(1)为使反应随开随用,随关随停,方框内应选用下图所示 装置(填字母代号)。
(2)实验室制取二氧化碳气体宜用的药品是 (填标号)。
①石灰石,②纯碱,③小苏打,④18.4 mol·L—1硫酸,⑤11.2mol·L—1盐酸,⑥蒸馏水,⑦木炭粉。
(3)在2装置内进行反应的离子方程式为 。检查装置气密性并装好药品后,点燃酒精灯之前待装置 (填数字编号)中出现 现象时,再点燃酒精灯。
(4)①若装置6中有黑色沉淀,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 ;
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
每年6月5日定为“世界环境日”,从1972年开始,每年均由联合国环境规划署确定一个主题,开展“世界环境日”活动。其中关于水的主题:1976年是“水!生命的重要源泉”,1981年是“保护地下水和人类食物链,防止有毒化学品的污染”,可见水的重要性。
水污染有两类:一类是自然因素造成的,如地下水流动把地层中某些矿物溶解,使某些地区水体盐分、微量元素浓度偏高或因植物腐烂中产生的毒物而影响了当地的水质。另一类是人为因素造成的,主要工业排放的废水。此外,还包括生活污染水、农田排水、降雨淋洗大气中的污染物以及堆积在地上的垃圾经降雨淋洗流入水体的污染物。
水体污染物种类繁多,按照所造成的环境污染情况大体有以下几种类型:
①水体的富营养化及危害。
某些工业废水、施用磷肥和氮肥的农田及生活污水(有含磷增净剂的洗涤剂)中,都含有氮和磷,它们并非有害元素,而是植物营养元素,引起藻类及浮游生物的迅速繁殖。导致水中氧气大量减少而使水生生物因缺氧而大量死亡、腐败,致使水质恶劣化。
②需氧物质污染及危害。
生活污水、食品加工和造纸工业废水,含有糖、蛋白质、油脂、木质素等有机物;在石油的开采、储运、炼制及使用过程中,由于原油和各种石油制品进入环境。这些物质悬浮或溶解于污水中,经微生物的化学作用而分解,在分解过程中需要消耗氧气,因而被称为需氧污染物。这类污染物造成厌氧分解,产生恶臭(生成硫化氢、氨和硫醇等有难闻气味),使水质进一步恶化。
③酸、碱、盐等无机物污染及危害。
④重金属污染及危害。
污染水体的重金属有汞、镉、铅、铬、钒、钴、钡等。其中以汞的毒性最大,镉、铅、铬也有较大危害。
重金属在工厂、矿山生产过程中随废水排出,进入水体后不能被微生物降解。经食物链富集,能逐级在较高级生物体内千百倍地增加含量,最终进入人体。1955年~1972年日本富士山县神能川蜮,日本三人金属矿业公司锌铅冶炼厂排放含镉废水,污染神通川。两岸居民和矿工出现怪病,患者腰、膝关节疼痛,随后遍及全身,最后骨骼萎缩,饮水不进,在衰弱中疼痛而死亡。
请根据上述材料,回答下列问题:
(1)氮和磷等是生物体内的必须元素,而池塘中氮、磷含量过高,反而会引起富营养化而导致大量水生生物的死亡,请分析说明原因。
(2)水中的动植物尸体在微生物的分解下能产生出硫化氢、氨等难闻的气体,问这些物质主要来源于何种有机物。
(3)工业上为了处理含 离子的酸水,采用以下处理方法:
离子的酸水,采用以下处理方法:
①往工业废水中加入适量的食盐。
②以铁作为阳极进行电解。
③鼓入空气。
经一段时间后,使废水中含铬量降到可排放的标准。
请用已学过的化学知识解释处理含 的工业废水的原因。
的工业废水的原因。
注: 开始沉淀的pH值为2.7,沉淀完全的pH值为3.7。
开始沉淀的pH值为2.7,沉淀完全的pH值为3.7。 开始沉淀的pH值为7.6,沉淀完全的pH值为9.6,并且
开始沉淀的pH值为7.6,沉淀完全的pH值为9.6,并且 呈絮状,不易从溶液中除去。
呈絮状,不易从溶液中除去。
(4)测定污水中 的含量,可以用
的含量,可以用 作为还原剂,采用适当的指示剂,对污水进行滴淀,若量取10.00mL污水,用0.0100mol/L的
作为还原剂,采用适当的指示剂,对污水进行滴淀,若量取10.00mL污水,用0.0100mol/L的 滴定,其共用去
滴定,其共用去 溶液12.00mol。已知
溶液12.00mol。已知 在酸性溶液中作氧化剂时,被还原成
在酸性溶液中作氧化剂时,被还原成 。
。
①写出 与
与 存在下反应的化学方程式。
存在下反应的化学方程式。
②计算污水中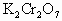 的物质的量浓度。
的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com