
题目列表(包括答案和解析)
空气的主要成分是N2,其次是O2。已知N2的化学性质不活泼,很难与其他物质发生反应,在标准状况下,液态氮的沸点是-195.8 ℃,远低于常温。最近,有的科学家根据蒸汽机的原理,发明了一种液态氮蒸汽机,它是利用液态氮吸收环境中的热量而汽化来驱动机车。运用能源环保知识,联系实际简要说明上述发明的优点。(写出3点理由)
① ,
② ,
③ 。
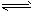 1/2N2O4(g) △H=- 26. 35 kJ/mol
1/2N2O4(g) △H=- 26. 35 kJ/mol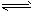 1/2N2O4(g)的影响如图所示。
1/2N2O4(g)的影响如图所示。 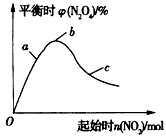
①在图中用虚线画出400℃时对应的图象;
②a、b、c三点中,NO2的转化率最高的是____(填字母)。
(4)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3)变成磁性氧化铁(Fe3O4)层,从而减缓锅炉锈蚀。若反 应过程中联氨转化为氮气,则每生成1 mol Fe3O4,转移电子的物质的量为_______________。
(5)联氨-空气燃料电池是一种碱性电池,电解质溶液是20% ~30%的氢氧化钾溶液。该电池放电时,负极的反应式为______________。

 |
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是_______________________。
(3)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率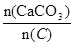 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(4)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率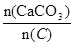 为何值?
为何值?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com