本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH
3)
2Ac+CO+NH
3=Cu(NH
3)
3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
.
(2)写出基态Cu
+的核外电子排布式
.
(3)配合物Cu(NH
3)
3(CO)Ac中心原子的配位数为
.
(4)写出与CO互为等电子体的离子
.(任写一个)
(5)在一定条件下NH
3与CO
2能合成化肥尿素[CO(NH
2)
2],尿素中 C原子轨道的杂化类型分别为
;1mol尿素分子中,σ键的数目为
.
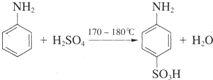
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
.
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
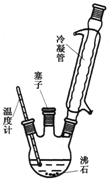
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
.
(2)步骤②中采用油浴加热,下列说法正确的是
(填序号).
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
.
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
,然后
,以防倒吸.
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是
.每次抽滤后均应将母液收集起来,进行适当处理,其目的是
.

 A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).