
题目列表(包括答案和解析)
| A.11.9 | B.11.9mol?L-1 |
| C.0.012mol?L-1 | D.无法计算 |
用二氧化锰与浓盐酸反应(加热)制得的氯气通入碘化钾溶液中,恰好完全反应后,可得到碘38.1g.
求:(1)在标准状况下,有多少升氯气通入KI溶液?
(2)制得这些氯气需消耗物质的量浓度为11.9mol/L的浓盐酸多少毫升?
| ||
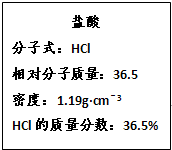 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com